Chapitre 2 : Une description moléculaire pour comprendre

Les états physiques
Lors d’un changement d’état, la masse ne change pas car il n’y a pas de modification du nombre de molécules.
Lors du passage de l’état solide à l’état liquide, le volume change car les molécules ne s’organisent pas de la même façon.

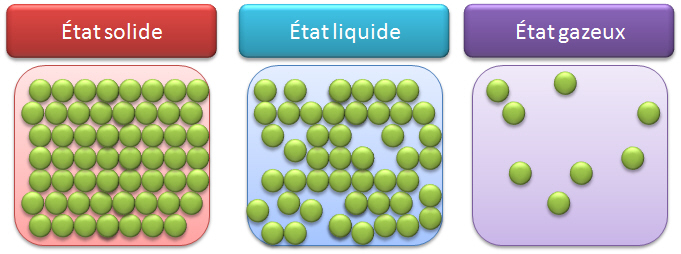
L’état solide est compact et ordonné : les molécules sont en contact, liés entre elles et quasi immobiles.
L’état liquide est compact mais désordonné : les molécules sont en contact et en mouvement.
L’état gazeux est dispersé et désordonné : les molécules sont espacées et agitées.
Explication moléculaire de différents phénomènes
Compressibilité d’un gaz / incompressibilité d’un liquide
Contrairement aux gaz, les liquides sont incompressibles : il n’existe pas d’espace entre les molécules pouvant être réduit pour les rapprocher.
Diffusion moléculaire dans les liquides et les gaz
Dans les gaz et les liquides, les mélanges finissent toujours homogènes car les molécules (très agitées) se heurtent et partent dans tous les sens.
